Answer:
La masa molar de la sustancia disuelta es de aproximadamente 138,473 g/mol
Step-by-step explanation:
Los parámetros dados son;
La masa de benceno en el recipiente = 100 gramos
La masa de benceno que se evapora del benceno puro = 1.273 gramos
La masa del soluto no volátil disuelto en 100 gramos de benceno = 10 gramos
La masa de benceno que se evapora de la mezcla = 1.205 gramos
Según la ley de Raoult, tenemos;
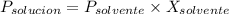
Dónde;
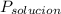 = La presión de vapor de la solución.
= La presión de vapor de la solución.
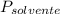 = La presión de vapor del solvente
= La presión de vapor del solvente
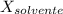 = La fracción molar del solvente
= La fracción molar del solvente
Por lo tanto;
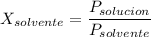
Según la ley de los gases ideales, tenemos;
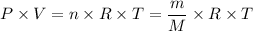
Dónde;
P = La presión del gas
V = El volumen ocupado por el gas
m = La masa del gas
M = La masa molar del gas
R = La constante universal de los gases
T = La temperatura del gas
n = El número de moles del gas
Por lo tanto;
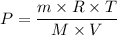
Donde R, T, M y V son constantes, tenemos P ∝ m
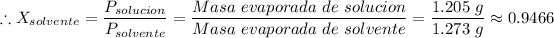
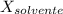 ≈ 0.9466
≈ 0.9466
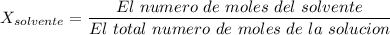
El número de moles del solvente, C₆H₆ = (Masa de C₆H₆) / (La masa molar de C₆H₆) = 100 g / (78.11 g.mol) ≈ 1.28025 moles
El número de moles del solvente, C₆H₆ ≈ 1.28025 moles
El número total de moles = El número de moles del solvente, C₆H₆ + El número de moles del soluto no volátil,
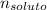
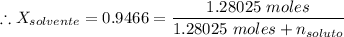
0.9466 × (1.28025 moles +
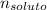 ) = 1.28025 moles
) = 1.28025 moles
1.21189 moles + 0.9466 ×
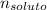 = 1.28025 moles
= 1.28025 moles
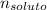 = (1.28025 - 1.21189)/0.9466 moles ≈ 0.07221635 moles
= (1.28025 - 1.21189)/0.9466 moles ≈ 0.07221635 moles
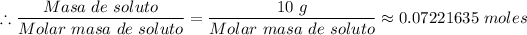
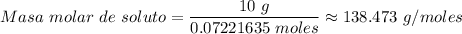
La masa molar de la sustancia disuelta (el soluto) ≈ 138,473 g/mol